
Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.
Suyzeko Company avait recherché un nouveau produit. Machine de photobiomodulation du cerveau, notre entreprise avait passé plus d'un an pour rechercher le produit, et nous avons invité le professeur à faire une recherche pour nous. Voir l'article suivant pour plus de détails.
Unité de recherche pour la médecine laser complémentaire et intégrative, l'unité de recherche en génie biomédical en anesthésie et médecine de soins intensifs, et TCM Research Center Graz, Université médicale de Graz, Auenbruggerplatz 39, EG19, 8036 Graz, Autriche
Reçu: 4 janvier 2019 / accepté: 15 janvier 2019 / Publié: 16 janvier 2019
photobiomodulation; cerveau; Stimulation LED (diode émettant de la lumière); thérapie lumineuse; longueur d'onde; accident vasculaire cérébral; démence; maladies mentales; saturation régionale de l'oxygène cérébral; imagerie thermique; Casque LED
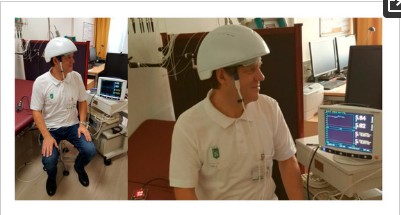
Figure 1. Première mesure avec le casque de photobiomodulation LED innovant (diode émettant de la lumière) (prototype de Suyzeko (Shenzhen Guangyang Zhongkang Technology Limited, Chine)) au TCM Research Center de l'Université médicale de Graz, en Autriche, en Europe, le 25 décembre 2018 .
L'équipement est actuellement basé sur la LED infrarouge en utilisant une longueur d'onde de 810 nm. Cette longueur d'onde a été prouvée récemment (2018) comme l'une des meilleures pour la stimulation transcrânienne laser / lumière [9]. Les résultats ont été confirmés par des mesures effectuées par notre équipe de recherche [5,6,7,8,10].

Les mesures des changements dans la saturation régionale de l'oxygène cérébral (RSO2) ont été effectuées à l'aide d'un instrument d'oxymètre IVS 5100C (Somanetics Corp., Troy, MI, USA). La spectroscopie proche infrarouge est une méthode non invasive pour mesurer le RSO2 à travers le crâne intact qui a été appliqué avec succès dans la recherche médicale de base et les indications cliniques pendant de nombreuses années [6]. La lumière proche infrarouge (730 et 805 nm) est émise par la peau, et après avoir passé différents types de tissus (peau et os), la lumière retournée est détectée à deux distances de la source de la lumière (3 et 4 cm). Sur la base de ce principe, l'absorption spectrale du sang dans les structures plus profondes (2 à 4 cm) peut être déterminée et définie comme le RSO2 [5,12]. Les capteurs ont été appliqués dans la zone frontale sur les côtés droit et gauche du cerveau du volontaire sain (voir figure 1). Pour minimiser l'influence de la lumière externe, la tête de cette zone a été recouverte d'une bande élastique pendant la procédure d'enregistrement et de stimulation. Après un temps de repos de 20 minutes, la stimulation LED a été allumée. Les résultats des trois sections (avant (20 min), pendant (15 min) et après (20 min) stimulation) sont indiqués sur la figure 3. Notez l'augmentation significative de RSO2 (côté gauche et droit) pendant et même après transcrânien Stimulation LED. Les changements de la température sont illustrés à la figure 4.
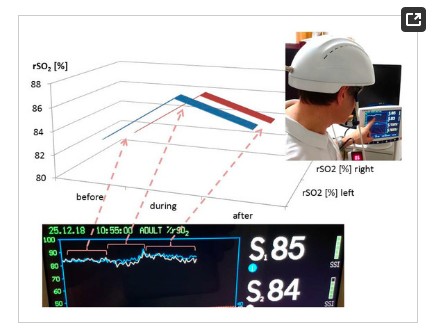
Figure 3. Résultats de la première mesure pilote avec le casque de stimulation LED de Suyzeko (Shenzhen, Chine). Notez l'augmentation de la saturation régionale de l'oxygène cérébral pendant et après la stimulation du côté gauche et droit.

La thérapie PBM a été développée il y a plus de 50 ans; Cependant, il n'y a toujours aucun accord commun sur les paramètres et les protocoles pour son application clinique. Certaines équipes de recherche ont recommandé l'utilisation d'une densité de puissance inférieure à 100 MW / cm2 et d'une densité d'énergie de 4 à 10 J / cm2 [11]. D'autres groupes recommandent jusqu'à 50 j / cm2 à la surface des tissus [11]. Des paramètres tels que la longueur d'onde, l'énergie, la fluence, la puissance, l'irradiance, le mode d'impulsion, la durée du traitement et le taux de répétition peuvent être appliqués dans une large gamme. Nos résultats préliminaires actuels ont montré une réponse claire de RSO2 cérébral par rapport à la stimulation LED. Cependant, il faut mentionner que la température a augmenté de manière significative et que ces effets doivent être pris en compte dans d'autres études en détail. Il y a aussi le fait que des études inefficaces dans des cellules avec une activité mitochondriale élevée semblent être dues plus souvent à une sur-dose qu'à un sous-dosage [11]. Par conséquent, des études cliniques concernant les doses de stimulation optimales sont nécessaires.
Le PBM transcrânien semble promettre de traiter différentes maladies mentales. Pitzschke et al. [13] ont également mesuré la propagation de la lumière dans différentes zones de la maladie de la maladie de Parkinson (PD), un tissu cérébral profond pertinent pendant l'illumination transcrânienne et transsphénoïdale (à 671 et 808 nm) d'une tête de cadavre et de paramètres optiques modélisés de tissu cérébral humain à l'aide de monte- Simulations de Carlo. Cette étude démontre qu'il est possible d'éclairer également les tissus cérébraux profonds transcrâniens et transsphénoïdalement. Cela ouvre des options thérapeutiques pour les personnes atteintes de MP ou d'autres maladies cérébrales nécessitant une luminothérapie [13].
Il y a eu plusieurs investigations concernant les effets indésirables possibles pour le PBM LED. Par exemple, Moro et al. a exploré les effets d'une application à plus long terme, jusqu'à 12 semaines, de PBM (670 nm) chez des singes macaques normaux et naïfs. Ils n'ont trouvé aucune base histologique pour les principales préoccupations de biosécurité associées au PBM délivrées par une approche intracrânienne [14]. Hennessy et Hamblin ont également souligné la sécurité déjà établie et le manque notable d'effets néfastes du PBM transcrânien [2].
Les résultats préliminaires sont très prometteurs; Cependant, des travaux de recherche supplémentaires sont nécessaires pour pouvoir utiliser, par exemple, ce nouveau type de PBM comme méthode thérapeutique. De nombreux chercheurs pensent que le PBM avec LED et / ou laser pour les troubles cérébraux deviendra l'une des applications médicales les plus importantes de la luminothérapie dans les années et les décennies à venir [3].
L'auteur ne déclare aucun conflit d'intérêts.
LET'S GET IN TOUCH

Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.

Fill in more information so that we can get in touch with you faster
Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.